在實驗室和海洋中構建用于測量浮游植物生物量、生理學和光合作用的高級熒光系統
1. 研究目的和內容
研究目的
該項目的目的是建造一種小型的臺式儀器,稱為F熒光I誘導和R馳預(mini-FIRe)系統,用于離散樣品分析和連續測量浮游植物在海洋中的豐度和生理狀況。與Rutgers團隊發明和開發的前代FRRF和FIRe熒光儀不同,新儀器將表現出增強的靈敏度(約10倍),可實時提供更多生理參數。新儀器的高靈敏度使得它們對于在公海的實地工作有巨大價值。
研究內容
使用可變熒光技術對浮游植物和其他光合作用生物的光合作用活性的評估 - 光合作用生物的生理狀態的快速和無損評估依賴于使用快速重復率熒光學 (FRRF) 及其技術后續熒光感應和放松 (FIRE) 技術。這項技術是由Rutgers團隊發明和開發的。評估光合作用生物生存能力的基本方法依賴于葉綠素"可變熒光"剖面的測量和分析,葉綠素是光合作用機構*的特性(Falkowski等人于2005年對此進行了審查)。"可變熒光"技術依賴于葉綠素熒光與光合作用過程效率之間的關系,并提供了一套全面的熒光和光合作用參數的有機體。光學測量是靈敏的,快速的,無損的,可以實時和原位完成。
這種方法和已實現的儀器學原理是在同行評審文獻中確立的(Falkowski and Kolber 1995; Kolber at al., 1998; Gorbunov et al., 2000, 2001; Gorbunov and Falkowski 2004)。最初是為研究水柱中的浮游植物而開發的,FRR技術提供了準確的信息,說明浮游植物群落的運作以及控制海洋初級生產力的環境因素的影響(e.g., Falkowski and Kolber 1995; Falkowski and Raven 2007; Behrenfeld et al., 1996; Coale et al, 2004; Falkowski et al, 2004)。使用臺式和潛水式FRR和FIRe熒光儀成為美國和世界上大多數生物海洋學項目不可分割的一部分。
已開發出F熒光I誘導和R馳預(FIRe)技術 ,以測量光合作用生物的一套全面的光合作用和生理特征(Gorbunov and Falkowski 2005)。 FIRe 技術基于對由一系列激發閃光引起的熒光瞬態的記錄和分析,這些閃光的強度、持續時間和間隔精確控制(圖 1 和 Gorbunov and Falkowski 2005)。 該技術提供了一套全面的參數,這些參數的特點是光合作用采光過程、光系統 II (PSII) 中的光化學以及光合作用電子傳輸到碳固定。由于這些過程對環境因素特別敏感,FIRe 技術為識別和診斷自然(營養限制、光化學和光刺激、熱應力等)和人為應激因素(如污染)提供了基礎。
圖1。FIRe 熒光瞬時的例子。熒光產量的動力學記錄為微秒時間分辨率,包括四個階段:(一階段,100 ms)100 ms的強短脈沖(稱為單周轉閃光,STF)適用于累積飽和PSII,并測量從Fo到Fm(STF)的熒光感應:(第二階段,500ms)弱調制光用于記錄500ms時間尺度上熒光產量的放松動能:(第三階段,50 ms)50ms 持續時間的強長脈沖(稱為多周轉閃光,MTF)用于飽和 PSII 和 PQ 庫:(第 4 階段,1 s) 弱調制光用于記錄 PQ 庫在 1s 的時間尺度內再氧化的動力學。 第 1 階段的分析提供:最小和至大熒光產量(Fo,Fm);PSII光化學電荷分離的量子效率Fv/Fm(STF);PSII 的功能橫截面,σPSII; 和連接因子(p)。第 2 階段為 PSII 接收方的電子傳輸提供時間常數(即Qa 受體側再氧化)。第 3 階段提供 Fm(MTF)和 Fv/Fm(MTF)。第 4 階段揭示了 PSII 和 PSI 之間的電子傳輸時間常數(PQ 庫的再氧化)。
可變熒光技術的生物物理背景- 在室溫下,葉綠素熒光主要產生于PSII。當PSII反應中心處于開放狀態(Qa氧化)時,熒光產量極小,Fo。當 Qa 還原(例如,通過暴露在強光下)時,反應中心關閉,熒光產量增加到其高水平 Fm。為了檢測Fo和Fm,FIRe技術記錄了由強烈的飽和脈沖光(~100 μs,稱為單周轉閃光,STF)引起的熒光感應(圖1第1階段)。熒光感應率與PSII的功能吸收橫截面成正比,而熒光上升的相對幅度Fv/Fm則由PSII光化學的量子效率來定義。熒光感應的形狀由單個光合作用單元之間的激發量轉移控制,并由"連接因子"(Kolber et al. 1998)定義。因此,在沒有能量轉移(p = 0)的情況下,熒光感應呈指數級,當p 增加到 ~0.5 到 0.7 的至大值時,就會變成反曲線。
PSII 受體側電子傳輸的動能(即Qa再氧化)是通過 STF 之后的熒光馳預動力學分析(圖 1 第 2 階段)評估的。熒光動力學由幾個部分組成,因為Qa再氧化的速度取決于第二個電子受體Q b的狀態,Qb作為移動雙電子受體工作:
Qa- Qb → Qa Qb- (150 - 200 ms) (1)
Qa- Qb- → Qa Qb= (600 - 800 ms) (2)
Qa- _ → Qa- Qb → Qa Qb- (~ 2000 ms) (3)
反應 (3) 與 Qb 最初脫離 D1 蛋白結合位點時的條件相對應。此外,一小部分電子傳輸受損的失活反應中心可能有助于馳預動力學中最慢的組件。FIRe 軟件使用 3 組件分析處理馳預動力學,以檢索電子傳輸的時間常數(即 Q 氧化 tQa)。
PSII 和 PSI 之間的電子傳輸的時間常數 tPSII-PSI 是從多周轉閃光(MTF,圖 1 中的第 3 階段和第 4 階段)之后的熒光馳預動力學分析中檢索到的。 在大多數生理條件下,這個時間常數是由質體醌(PQ)庫再氧化的速度決定的,并且是一個數量級比tQa慢一個數量級。
測量一系列環境光強的FIRe熒光參數,可以重建光合作用電子傳輸的速率,Pf,作為光強的函數(光合作用與光強曲線)(Kolber and Falkowski, 1993)。Pf 與光照產物和環境光下測量的光化學量子產量成正比(DF'/Fm')。分析這些光合作用與光強曲線提供了光合作用至大電子傳遞速率(Pmax)和光飽和系數(Ek)。光合作用與輻射測量使用 FIRe 的光化光源 (ALS) 進行,該光源通過 FIRe 數據采集軟件由計算機控制。
研發背景和專業知識 – Rutgers團隊的成員在可變熒光技術和方法的研發方面積累了超過 20 年的經驗。他們發明并開發了10多項生物物理研究的*儀器(參見相關同行評審出版物的附錄參考清單)。
2. 儀器介紹
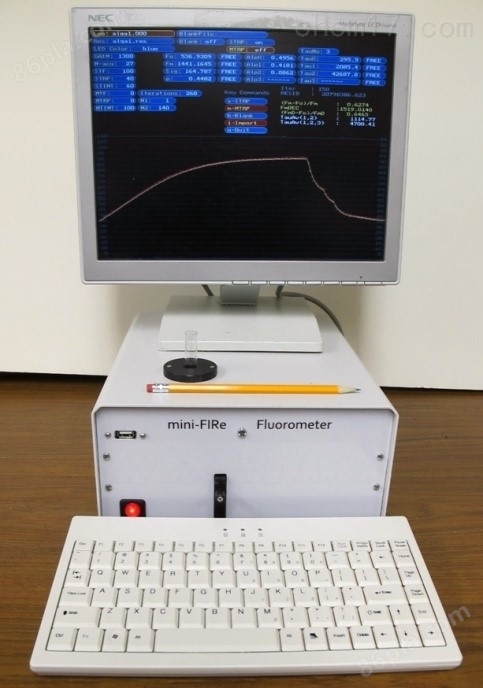
mini-FIRe基于與之前臺式FIRe儀器相同的生物物理原理(Gorbunov and Falkowski 2005),但新儀器更緊湊3倍,靈敏度提高10倍。葉綠素濃度的下限低至 ~0.005 mg/m3,這使得mini- FIRe對于在公海進行現場采樣非常有價值。
在這里,Rutgers團隊提議建造一個mini-FIRe(圖2)該儀器將用于離散樣品分析(例如,從站點的尼斯金瓶收集的樣品)和/或在海洋中持續進行取樣。儀器將配備一個流經的樣品室,用于連續繪制浮游植物生物量和光合作用特性。以下是mini-FIRe記錄的生理參數列表和儀器技術規格mini-FIRe(圖2)。該儀器將用于離散樣品分析(例如,從站點的尼斯金瓶收集的樣品)和/或在海洋中持續進行取樣。該儀器將配備一個流經的樣品室,用于連續繪制浮游植物生物量和光合作用特性。以下是mini-FIRe記錄的生理參數列表和儀器技術規格。
圖2 mini-FIRe熒光儀,具有增強的靈敏度。
測量參數:
●暗適應后最小和至大熒光產量(Fo, Fm)
●光適應下有效、最小和至大熒光產量(F', Fo', Fm') *
●光系統II、PSII 中光化學至大有效量子產量(Fv/Fm 和DF'/F m))
●三波長下功能性PSII吸收截面積(sPSII)
●光合作用單元之間的能量轉移效率("連接因子")
●PSII 受體側電子傳遞時間常數(Q a 到Qb,Qa 到 Qb-)
●PSII 和 PSI 之間的光合作用電子傳輸時間常數
●電子傳遞速率,ETR,作為光強的函數 *
●光化學淬火系數 (qP)和非光化學淬火系數 (NPQ) *
●至大光合速率、初始斜率和光合作用周轉時間(從 F 與 E 曲線得到)
●這些參數是使用光化光源 (ALS) 測量,并記錄為光強曲線。
mini-FIRe 系統的技術規格:
●靈敏度:0.005 - 100 mg/m3葉綠素a(可通過添加中性密度減壓過濾器提高采樣濃度)
●激發光源:藍色(峰值波長450 nm,30 nm帶寬),綠色(峰值波長530 nm,40 nm帶寬),橙色(峰值波長590 nm,30 nm帶寬),用于選擇性激發不同功能組的浮游植物。
●發射檢測:680 nm(葉綠素a)和880 nm(細菌葉綠素a),其他波長可使用可更換的發射濾光片進行選擇。
●尺寸: 10 x 5 x 12 英寸